Porteur de projet : C. Moali
La cicatrisation est un exemple de processus impliquant un remodelage important, avec plusieurs étapes : hémostase, inflammation, angiogenèse, ré-épithélialisation, formation d’une matrice extracellulaire provisoire (tissu de granulation), contraction de la plaie et remodelage matriciel. Les protéases BMP-1/tolloid-like (BTPs) jouant un rôle essentiel dans l’assemblage de la matrice, nous avons supposé qu’elles seraient surexprimées au moment des phases de granulation et de remodelage. Ceci a été démontré dans un modèle de cicatrisation de la cornée ainsi que sur des cornées humaines issues de patients ayant subi une transplantation (figure). Nous caractérisons également d’autres types de processus de réparation tissulaire (peau et cœur) pour déterminer si cette observation est généralisable.
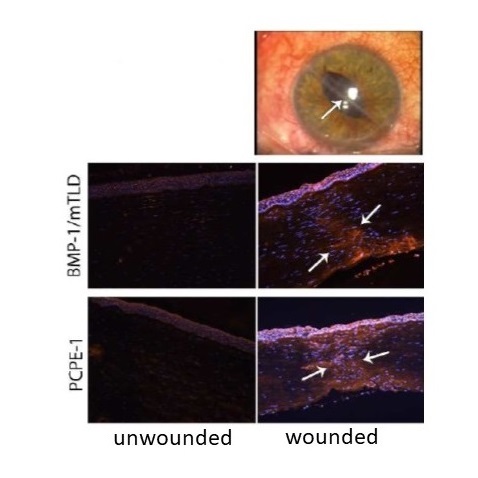
Détection par immuno-fluorescence des protéases BMP-1/mTLD et de la protéine régulatrice PCPE-1 au niveau d’une lésion centrale de la cornée ayant conduit à la formation d’une opacité cornéenne (D’après Malecaze et al. Invest. Ophthalmol. Vis. Sci. 2014).
Pour mieux comprendre le rôle joué par les BTPs et les protéases associées (ADAMTS-2, 3 et 14 ; méprines α et β) dans la cicatrisation, nous utilisons des approches de protéomique quantitative qui permettent de mettre en évidence les substrats clivés par ces protéases dans des modèles cellulaires ou tissulaires. Ces approches nous ont permis de révéler plusieurs nouvelles fonctions des BTPs et des ADAMTSs, notamment dans le contrôle de l’adhésion cellulaire et de l’activité du TGF-β qui régule plusieurs aspects fondamentaux de la cicatrisation (inflammation, synthèse des protéines matricielles, contraction des plaies).
Principales techniques utilisées
• PCR quantitative
• Immuno-fluorescence / western-blots / ELISA
• Biologie cellulaire
• Tests enzymatiques
• Spectrométrie de masse et analyse protéomique
Sélection de publications :
BMP-1 disrupts cell adhesion and enhances TGF-beta activation through cleavage of the matricellular protein thrombospondin-1. Anastasi C, Rousselle P, Talantikite M, Tessier T, Cluzel C, Bachmann A, Mariano N, Dussoyer M, Alcaraz LB, Fortin L, Aubert A, Delolme F, El Kholti N, Armengaud J, Fournié P, Auxenfans C, Valcourt U, Vadon-Le Goff S, Moali C. Science Signaling 2020; 13(639): eaba3880.
C-terminal proteolysis of the collagen VI α3 chain by BMP-1 and proprotein convertase(s) releases endotrophin in fragments of different sizes. Heumüller SE, Talantikite M, Napoli M, Armengaud J, Mörgelin M, Hartmann U, Sengle G, Paulsson M, Moali C, Wagener R. J Biol Chem. 2019;294(37):13769-13780.
Interaction of Complement Defence Collagens C1q and Mannose-Binding Lectin with BMP-1/Tolloid-like Proteinases. Lacroix M, Tessier A, Dumestre-Pérard C, Vadon-Le Goff S, Gout E, Bruckner-Tuderman L, Kiritsi D, Nyström A, Ricard-Blum S, Moali C, Hulmes DJS, Thielens NM. Sci Rep. 2017;7(1):16958.
Determination of the substrate repertoire of ADAMTS2, 3, and 14 significantly broadens their functions and identifies extracellular matrix organization and TGF-β signaling as primary targets. Bekhouche M, Leduc C, Dupont L, Janssen L, Delolme F, Vadon-Le Goff S, Smargiasso N, Baiwir D, Mazzucchelli G, Zanella-Cleon I, Dubail J, De Pauw E, Nusgens B, Hulmes DJ, Moali C, Colige A. FASEB J. 2016;30(5):1741-56.
Proteolytic control of TGF-β co-receptor activity by BMP-1/tolloid-like proteases revealed by quantitative iTRAQ proteomics. Delolme F, Anastasi C, Alcaraz LB, Mendoza V, Vadon-Le Goff S, Talantikite M, Capomaccio R, Mevaere J, Fortin L, Mazzocut D, Damour O, Zanella-Cléon I, Hulmes DJ, Overall CM, Valcourt U, Lopez-Casillas F, Moali C. Cell Mol Life Sci. 2015;72(5):1009-27.
Upregulation of bone morphogenetic protein-1/mammalian tolloid and procollagen C-proteinase enhancer-1 in corneal scarring. Malecaze F, Massoudi D, Fournié P, Tricoire C, Cassagne M, Malbouyres M, Hulmes DJ, Moali C, Galiacy SD. Invest Ophthalmol Vis Sci. 2014;55(10):6712-21



