Porteur de projet : Frédéric Mallein-Gerin
Personnes impliquées dans le projet : Delphine Vertu-Ciolino, Marielle Pasdeloup , Jean-Daniel Malcor, Jérôme Lafont, Mourad Bekhouche
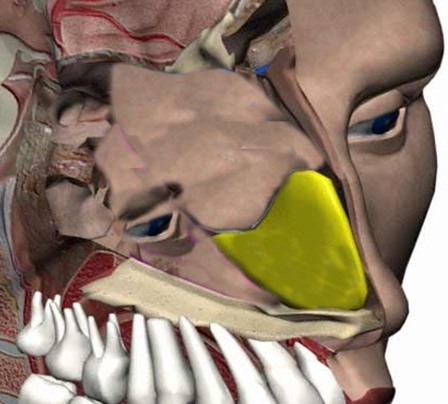
La reconstruction du cartilage nasal reste un défi pour tout chirurgien cervico-facial. Les demandes de remplacement des défauts de cartilage nasal après une résection carcinologique, traumatique ou congénitale et les rhinoplasties esthétiques sont en constante augmentation. Il faut souligner que la perte ou la déformation du nez est très pénalisante sur le plan social et sur le plan respiratoire et entraîne une altération majeure de la qualité de vie.
Des options chirurgicales sont disponibles pour réparer les défauts de cartilage dans le nez mais ces techniques ne sont pas idéales: les difficultés d’obtention du cartilage, la morbidité au niveau du site donneur et la durée/complexité de la procédure chirurgicale limitent l’utilisation de greffons autologues; les greffons homologues sont soumis au risque d’infection; les matériaux alloplastiques sont associés à un risque élevé d’extrusion et de rejet. Minimiser la réponse immunitaire contre le greffon est donc un enjeu majeur pour assurer une bonne chance de succès de la greffe.
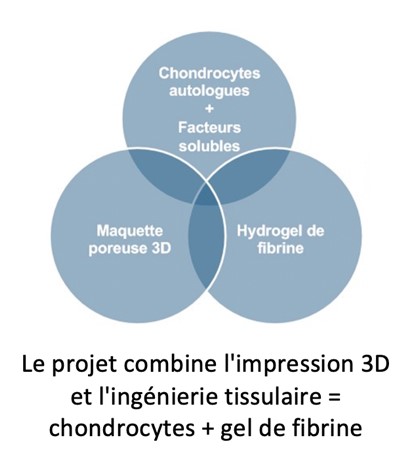
Nous proposons de fabriquer une cloison nasale prothétique hautement biocompatible à partir d’un biomatériau non résorbable imprimé en 3D, colonisé et recouvert d’un gel de chondrocytes autologues produit in vitro par ingénierie tissulaire.
Sélection de publications :
1-Dufour A, Lafont JE, Buffier M, Verset M, Cohendet A, Contamin H, Confais J, Sankar S, Rioult M, Perrier-Groult E, Mallein-Gerin F. (2021) Repair of full-thickness articular cartilage defects using IEIK13 self-assembling peptide hydrogel in a non-human primate model. Sci Rep. Feb 25;11(1):4560. doi: 10.1038/s41598-021-83208-x. PMID: 33633122.
2- Dufour A, Buffier M, Vertu-Ciolino D, Disant F, Mallein-Gerin F, Perrier-Groult E. Combination of bioactive factors and IEIK13 self-assembling peptide hydrogel promotes cartilage matrix production by human nasal chondrocytes. J Biomed Mater Res A. 2019 Apr;107(4):893-903. doi: 10.1002/jbm.a.36612. Epub 2019 Jan 31.
3- Durbec M, Mayer N, Vertu-Ciolino D, Disant F, Mallein-Gerin F, Perrier-Groult E. (2014)[Reconstruction of nasal cartilage defects using a tissue engineering technique based on combination of high-density polyethylene and hydrogel].Pathol. Biol. 62 : 137-145.
Collaborations :
C’est un projet qui associe notre équipe avec la plateforme d’innovation technologique 3dFab (Christophe Marquette) UMR CNRS 5246 et la Fédération d’Oto-Rhino-Laryngologie de Chirurgie Cervico-Maxillo-Faciale et d’Audiophonologie, Hôpital Edouard Herriot (Delphine Vertu-Ciolino).



