Porteur de projet : Danielle Arruda (MCU)
Personnes impliquées dans le projet : JY Exposito (CR CNRS), Claire Monge (CR CNRS), Sophie Richard (MCU), Nicolas Ellinger (PhD student), Laurie Dechamboux (PhD student), Valentine Ginet (PhD student), Pierre Libeau (IE), Céline Coiffier (IE).
Depuis 20 ans, notre groupe s’intéresse à la conception de vaccins, et notamment le design d’un vaccin anti-VIH qui est toujours un défi majeur. Pour cela, nous avons développé un nouveau concept de vaccin basé sur les nanoparticules (NPs) de PLA que nous déployons dans 3 directions :
Objectif 1 : les NPs et l’immunité innée : l’utilisation des ligands PRR et la signalisation nf kappa B pour la manipulation intra-cellulaire des cellules présentatrices d’antigène (APCs) (modèle de VIH et S. aureus).
Ce projet s’intègre dans le contexte de la recherche actuelle de vaccin utilisant la voie de l’immunité innée pour augmenter le potentiel d’adjuvantation et optimiser les composants des vaccins sous-unitaires. La reconnaissance des PAMPs (Pathogen-associated molecular patterns) à travers les récepteurs TLR (Toll Like receptors) ou NLR (NOD-Like receptor) spécifiques, et l’identification des ligands synthétiques a ouvert une nouvelle porte dans la recherche sur les adjuvants. Comme ces molécules peuvent être encapsulées dans des NPs biodégradables, nous sommes capables de co-délivrer l’antigène vaccinal et la molécule immunostimulante aux APCs. Notre hypothèse de travail est basée sur le fait que nous pouvons cibler spécifiquement la cascade de régulation qui contrôle la détection des PRRs à travers des ligands spécifiques (tels que TLR2, NOD2, TLR7/8, ou des molécules chimériques), et amplifier ou moduler les réponses immunitaires directes contre l’antigène porté par la NP, spécialement dans les ganglions lymphatiques drainants.
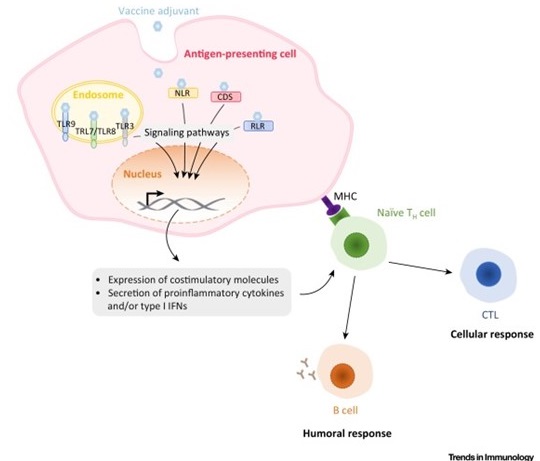
Mécanismes d’action des adjuvants ciblant les récepteurs intracellulaires. Les ligands PRR intracellulaires stimulent les APCs pour exprimer les molécules co-stimulantes, des cytokines pro-inflammatoires et/ou des interférons de type I (IFNs). Ces signaux induisent le recrutement de cellules immunitaires au site d’infection et dirige la réponse immunitaire vers des immunités de type 1 ou 2. Abbreviations: CDS, cytosolic DNA sensor; CTL, cytotoxic T lymphocyte; MHC, major histocompatibility complex; NLR, NOD-like receptor; RLR, RIG-like receptor, TH cell, helper T cell; TLR, Toll-like receptor. D’après Gutjahr et al, Trends Immunol. 2016 Sep;37(9):573-87
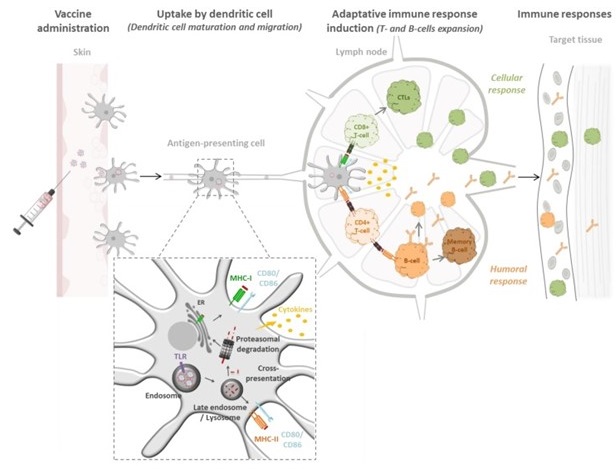
Adjuvants vaccinaux à base de NPs polymériques biodegradable pour le ciblage des ganglions lymphatiques.
(Gutjahr A, Vaccines (Basel). 2016 Oct 12;4(4))
Objectif 2 : NPs de PLA et le transport antigénique
De par leur nature particulaire et leur charge négative, toutes les protéines / peptides peuvent être adsorbé(e)s à la surface des NPs de PLA, formant une couronne protéique autour de la particule. Comme une telle association peut induire des changements conformationnels, nous développons des outils innovants pour modéliser ses interactions et prédire l’exposition des épitopes. Ces approches sont actuellement testées sur deux formulations vaccinales, l’une basée sur une glycoprotéine de VIH-1 (gp160) et l’autre sur une glycoprotéine de la grippe (HA, Hemagglutinine), les deux projets étant financés par des fonds nationaus (ANRS) et internationaux (ERANET : Flunanoair).
Objectif 3 : NPs de PLA et vaccins à ARNm
Si les NPs sont adaptées à la présentation d’antigènes vaccinaux à leur surface et à l’incorporation d’agents actifs dans leur matrice, leur charge de surface négative restreint leur utilisation directe comme vecteur d’acides nucléiques tels que les ARNm et l’ADN dans un contexte de conception de vaccin. C’est pourquoi, pour proposer un ealternative aux approches récentes d’encapsulation des acides nucléiques dans la matrice des NPs, nous mettons au point de nouveaux procédés de formulation pour le transport des ANRm. Nos 2 stratégies sont soit l’utilisation d’un peptide (CPP, cell penetrating peptide) en créant un pré-complexe ARNm / CPP avant leur adsorption, soit l’utilisation d’un polymère alternatif pour le recouvrement des NPs de PLA. Pour explorer ces domaines de recherche, nous avons obtenu 2 financements concernant les vaccins anti-VIH (ERANET : HIVERA : NanoVac) et un financement ANR (Fish-RNAvax) coordiné par notre groupe.
Séléction de publications :
Gutjahr A, Papagno L, Nicoli F, Lamoureux A, Vernejoul F, Lioux T, Gostick E, Price DA, Tiraby G, Perouzel E, Appay V, Verrier B, Paul S. (2017) Cutting Edge: A Dual TLR2 and TLR7 Ligand Induces Highly Potent Humoral and Cell-Mediated Immune Responses. J Immunol. 198(11):4205-4209.
Verrier B, Paul S, Terrat C, Bastide L, Ensinas A, Phelip C, Chanut B, Bulens-Grassigny L, Jospin F, Guillon C. (2017) Exploiting Natural Cross-reactivity between Human Immunodeficiency Virus (HIV)-1 p17 Protein and Anti-gp41 2F5 Antibody to Induce HIV-1 Neutralizing Responses In Vivo. Front Immunol. 8:770.
Gutjahr A, Phelip C, Coolen AL, Monge C, Boisgard AS, Paul S, Verrier B. (2016) Biodegradable Polymeric Nanoparticles-Based Vaccine Adjuvants for Lymph Nodes Targeting. Vaccines (Basel). 4(4).
Pavot V, Climent N, Rochereau N, Garcia F, Genin C, Tiraby G, Vernejoul F, Perouzel E, Lioux T, Verrier B, Paul S. (2016) Directing vaccine immune responses to mucosa by nanosized particulate carriers encapsulating NOD ligands. Biomaterials. 75:327-339.
Rochereau N, Pavot V, Verrier B, Ensinas A, Genin C, Corthésy B, Paul S. (2015) Secretory IgA as a vaccine carrier for delivery of HIV antigen to M cells. Eur J Immunol. 45(3):773-9.
Pavot V, Berthet M, Rességuier J, Legaz S, Handké N, Gilbert SC, Paul S, Verrier B. (2014) Poly(lactic acid) and poly(lactic-co-glycolic acid) particles as versatile carrier platforms for vaccine delivery. Nanomedicine (Lond). 9(17):2703-18.
Pavot V, Rochereau N, Rességuier J, Gutjahr A, Genin C, Tiraby G, Perouzel E, Lioux T, Vernejoul F, Verrier B, Paul S. (2014) Cutting edge: New chimeric NOD2/TLR2 adjuvant drastically increases vaccine immunogenicity. J Immunol. 193(12):5781-5.
Collaborations: T. De France, ADITEC members, Adjuvatis, S. Paul, B. Combadière, R. Le Grand, T. VanCott (NIAID), Sanofi Pasteur, GSK, F. Garci (Barcelona)
Projets financés : Aditec, Pierre Bergé Sidaction, bioAster, HIVERA, H2020 ; ANRS phD (feb2015-2018), ANR MemoSign.



