Porteur de projet : C. Moali et S. Vadon-Le Goff
La formation des fibres de collagène est un processus complexe impliquant à la fois des étapes intracellulaires et extracellulaires.
• Au niveau intracellulaire, les chaines polypeptidiques sont synthétisées, modifiées par plusieurs types de modifications post-traductionnelles (hydroxylations, glycosylations, ponts disulfures etc) et assemblées en trimère de procollagènes. Cette dernière étape est cruciale car elle implique la reconnaissance spécifique des chaines avec la bonne composition et stœchiométrie pour garantir qu’une cellule qui synthétise plusieurs types de collagènes ne produira pas de molécules chimériques non fonctionnelles. Ce mécanisme de reconnaissance est contrôlé pour les collagènes fibrillaires par le domaine C-terminal appelé C-propeptide.
Un de nos thèmes de recherche consiste à comprendre les détails moléculaires qui gouvernent ces processus de reconnaissance au niveau des différents C-propeptides et comment les mutations qui affectent ces domaines peuvent conduire à des maladies génétiques (Ostéogenèse Imparfaite, Chondrodysplasies, Ehlers-Danlos etc).
• Au niveau extracellulaire, après sécrétion des molécules de procollagènes, des maturations protéolytiques sont nécessaires pour diminuer leur solubilité et déclencher la formation des fibres. Les principales protéases impliquées sont les protéases BMP-1/tolloid-like (BTPs), méprines et ADAMTS-2, 3 et 14. Les BTPs sont assistées par une glycoprotéine de 50 kDa nommée Procollagen C-Proteinase Enhancer-1 (PCPE-1) qui peut augmenter significativement l’efficacité des clivages. De façon intéressante, PCPE-1 est spécifique des procollagènes, sans affecter le clivage des autres substrats des BTPs, et permet d’accélérer fortement la formation des fibres de collagènes dans certains contextes physiopathologiques (développement, réparation tissulaire…).
Nous essayons de comprendre comment fonctionnent les complexes protéolytiques, à deux (protéase-substrat, substrat-activateur, protéase-activateur) ou trois (protéase-substrat-activateur) partenaires, impliqués dans la maturation des procollagènes fibrillaires.
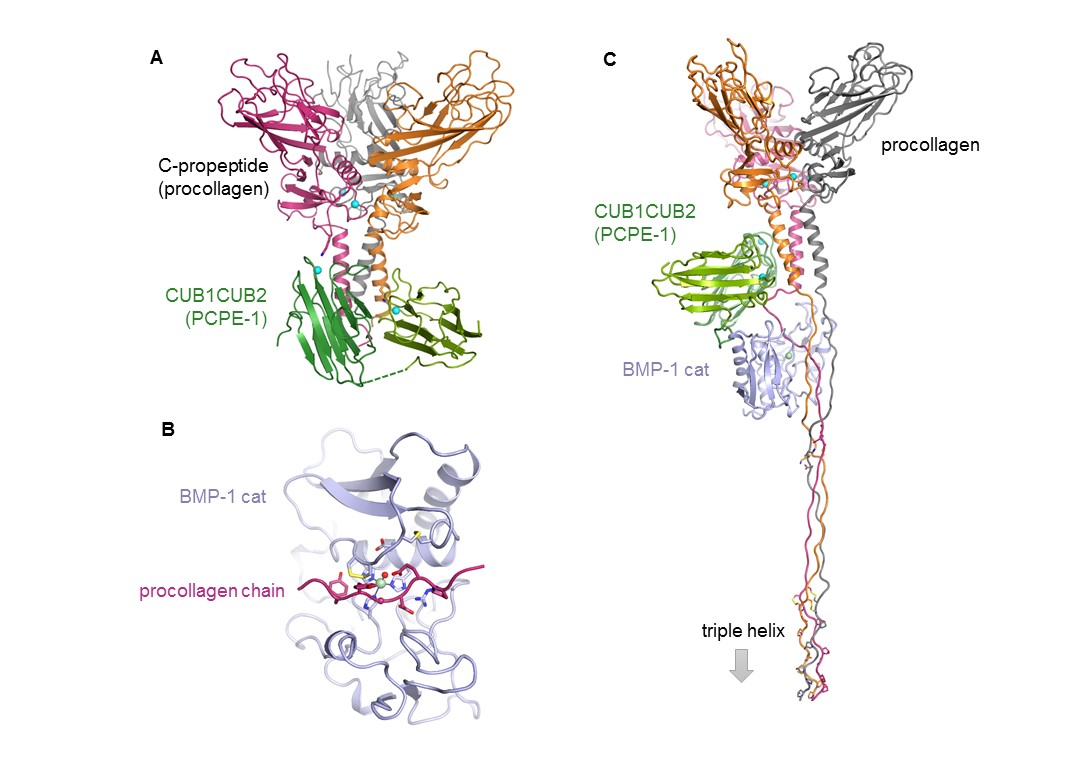
(A) Structure cristallographique du complexe entre le C-propeptide du collagène III et la partie active de la protéine PCPE-1 (CUB1CUB2). (B) Modèle d’une chaîne de procollagène III dans le site catalytique de la métalloprotéase BMP-1. (C) Modèle global du complexe de maturation protéolytique des procollagènes. (D’après Pulido et al. Structure 2018).
Principales techniques utilisées
• Production et purification de protéines en cellules eucaryotes
• Enzymologie
• Résonance plasmonique de surface / fluorescence / dichroïsme circulaire
• Spectrométrie de masse
• Diffusion des rayons X
• Cryo-microscopie électronique
• Cristallographie
Sélection de publications :
Structural basis of fibrillar collagen trimerization and related genetic disorders. Bourhis JM, Mariano N, Zhao Y, Harlos K, Exposito JY, Jones EY, Moali C, Aghajari N, Hulmes DJ. Nat Struct Mol Biol. 2012, 19(10):1031-6
Procollagen C-proteinase enhancer grasps the stalk of the C-propeptide trimer to boost collagen precursor maturation. Bourhis JM, Vadon-Le Goff S, Afrache H, Mariano N, Kronenberg D, Thielens N, Moali C, Hulmes DJ. Proc Natl Acad Sci U S A. 2013, 110(16):6394-9
Clinical, structural, biochemical and X-ray crystallographic correlates of pathogenicity for variants in the C-propeptide region of the COL3A1 gene. Stembridge NS, Vandersteen AM, Ghali N, Sawle P, Nesbitt M, Pollitt RC, Ferguson DJ, Holden S, Elmslie F, Henderson A, Hulmes DJ, Pope FM. Am J Med Genet A. 2015, 167A(8):1763-72.
Structural basis of homo- and heterotrimerization of collagen I. Sharma U, Carrique L, Vadon-Le Goff S, Mariano N, Georges RN, Delolme F, Koivunen P, Myllyharju J, Moali C, Aghajari N, Hulmes DJ. Nat Commun. 2017, 8:14671.
Structural basis for the acceleration of procollagen processing by procollagen C-proteinase enhancer-1. Pulido D, Sharma U, Vadon-Le Goff S, Hussain SA, Cordes S, Mariano N, Bettler E, Moali C, Aghajari N, Hohenester E, Hulmes DJ. Structure 2018, 26: 1384-92.



