Projet 2A. Role de miR-30a dans le vieillissement et l’autophagie de l’épiderme. Chef de projet: F. Chevalier
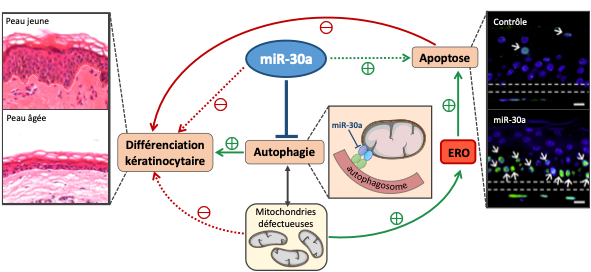
L’homéostasie de l’épiderme est assurée par un ensemble de mécanismes génétiques qui tendent à être perturbés au cours du vieillissement chronologique. Nous avons récemment identifié plusieurs petits ARNs non-codants (micro-ARNs) modulés par le vieillissement chronologique dans l’épiderme humain, notamment le miR-30a dont la forte induction avec l’âge perturbe la fonction barrière de l’épiderme (Muther C. et al. 2017).
Ce projet vise à comprendre les mécanismes moléculaires sous le contrôle de miR-30a. Notre hypothèse est que le miR-30a est un régulateur des processus autophagiques qui vont être perturbés avec l’âge et ainsi impacter la différenciation normale des kératinocytes mais aussi leur survie. Par ailleurs, nous avons constaté que le miR-30a était fortement enrichi dans les exosomes relargués par les kératinocytes âgés. Nous étudions donc la transmission du miR-30a au sein de l’épiderme via les exosomes, et l’évolution du profil des cellules qui reçoivent ce message.
Publication récente de l’équipe sur le sujet :
Muther C, Jobeili L, Garion M, Heraud S, Thepot A, Damour O, Lamartine J. An expression screen for aged-dependent microRNAs identifies miR-30a as a key regulator of aging features in human epidermis. Aging 2017 Nov 19 ;9(11) :2376-2396
Projet 2B – Rôle du TRPV1 dans l’inflammation vasculaire associée au psoriasis. Chef de projet : B. Fromy
Largement exprimé dans les terminaisons nerveuses sensorielles de la peau, TRPV1 (transient receptor potential vanilloid receptor subtype 1) est également exprimé par les kératinocytes épidermiques et les microvaisseaux cutanés. Nous émettons donc l’hypothèse qu’en plus du TRPV1 nerveux, les récepteurs TRPV1 des cellules non neuronales pourraient être impliqués dans l’inflammatoire vasculaire associée au psoriasis.
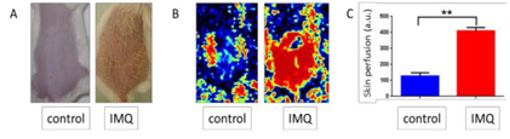
Le modèle murin de psoriasis le plus utilisé est le modèle de dermatite psoriasiforme induite par applications topiques d’imiquimod (IMQ) que nous avons précédemment utilisé dans notre laboratoire (Jabeen et al. Pharmaceutics 2020, Boisgard et al. Eur J Pharm Biopharm 2017). Nos données préliminaires montrent que ces lésions psoriasiques étaient associées à une inflammation vasculaire (comme indiqué ci-dessous).
Ce projet vise à 1) identifier le rôle du TRPV1 et quelles cellules exprimant TRPV1 jouent un rôle clé dans le cercle vicieux de l’inflammation, 2) étudier l’implication de la microcirculation qui est peu étudiée dans le contexte du psoriasis, 3) comprendre les communications entre les différents types cellulaires (neurones, kératinocytes basaux et différenciés et cellules endothéliales) en ce qui concerne l’activation des neuropeptides, des cytokines et du TRPV1.
Publications récentes de l’équipe sur ce thème :
Jabeen M, Boisgard AS, Danoy A, El Kholti N, Salvi JP, Boulieu R, Fromy B, Verrier B, Lamrayah M. Advanced Characterization of Imiquimod-Induced Psoriasis-Like Mouse Model. Pharmaceutics. 2020; 12(9):789. doi: 10.3390/pharmaceutics12090789.
Boisgard AS, Lamrayah M, Dzikowski M, Salmon D, Kirilov P, Primard C, Pirot F, Fromy B, Verrier B. Innovative drug vehicle for local treatment of inflammatory skin diseases: ex vivo and in vivo screening of five topical formulations containing poly(lactic acid) (PLA) nanoparticles. Eur J Pharm Biopharm 2017; 116: 51-60.
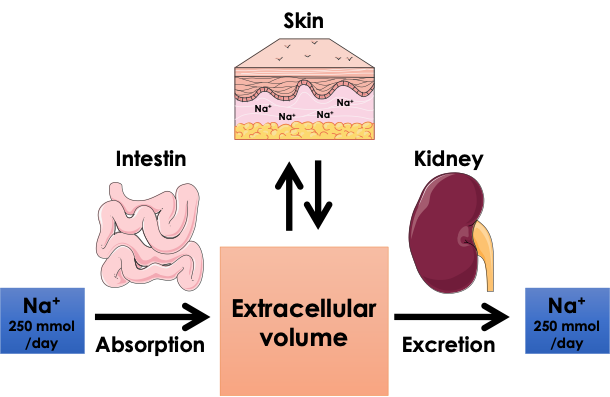
Projet 2C – Role du sodium et du chlore dans la dysfunction vasculaire cutanée. Chef de projet : N. Picard
Le contenu en sodium (Na+) et en chlorure (Cl-) de l’organisme sont des variables très régulées car elles influencent un grand nombre de fonctions physiologiques comme par exemple le volume extracellulaire (essentiellement le volume et la composition du sang). De nombreuses études chez l’homme et chez l’animal ont montré qu’un apport excessif en chlorure de sodium (présent dans le sel de table) est un facteur de risque aggravant les conséquences de l’hypertension ou du diabète. La restriction sodée est souvent proposée à ces patients permettant notamment de limiter les atteintes des vaisseaux sanguins, du cœur et des reins dans ces maladies. Le modèle classique de régulation de la balance sodée décrit un équilibre extrêmement fin entre les entrées de NaCl provenant de l’alimentation et ses sorties coordonnées par le rein. Récemment, il a été décrit que la peau stocke du sodium et il a été montré qu’elle joue un rôle important dans la balance sodée.
Ce projet a plusieurs objectifs :
– Comprendre les mécanismes permettant la régulation du stock cutané de sodium et de chlorure
– Déterminer l’influence de ces ions sur la plasticité des vaisseaux et leurs capacités à se contracter ou dilater. (Dysfonction vasculaire)
– Décrire les mécanismes rénaux qui régulent la balance du NaCl de l’organisme et impactent son stockage dans la peau. Nous nous intéressons actuellement à un type cellulaire de l’épithélium rénal, les cellules intercalaires qui sont impliquées dans la régulation de la composition en sodium, chlore et protons (régulation du pH) de l’organisme