Porteur de projet : Maxime Ducret
Personnes impliquées dans le projet : M. Bekhouche, J-C Farges, M. Pasdeloup, M Lévêque, S. Gobert
Les infections carieuses sont considérées comme un problème de santé publique majeur par l’Organisation Mondiale de la Santé. Les caries sont causées par les bactéries du microbiote buccal, qui dégradent l’émail et la dentine, jusqu’à ce que la pulpe dentaire soit atteinte et qu’elle nécrose. Un des challenges clés du traitement de la nécrose pulpaire est la désinfection de l’endodonte (partie interne de la dent). En effet, cet espace est très petit, intriqué, poreux, et constitue un environnement idéal pour la croissance bactérienne et la formation de biofilms. Les traitements endodontiques consistent actuellement en des procédures de « dévitalisation » qui laissent la dent morte. Ces techniques ont des limites, une des plus communes étant la réinfection. L’unique solution face à ces réinfections pourrait être une régénération de la pulpe dentaire. Deux types d’approches sont actuellement proposées dans le but de reconstruire le tissu pulpaire (Figure 1) : – une « cell-based strategy » qui nécessite d’utiliser des cellules exogènes et un biomatériau, – une « cell-free strategy » qui propose de laisser les cellules de l’hôte venir coloniser un matériau pour reconstruire une nouvelle pulpe dentaire.
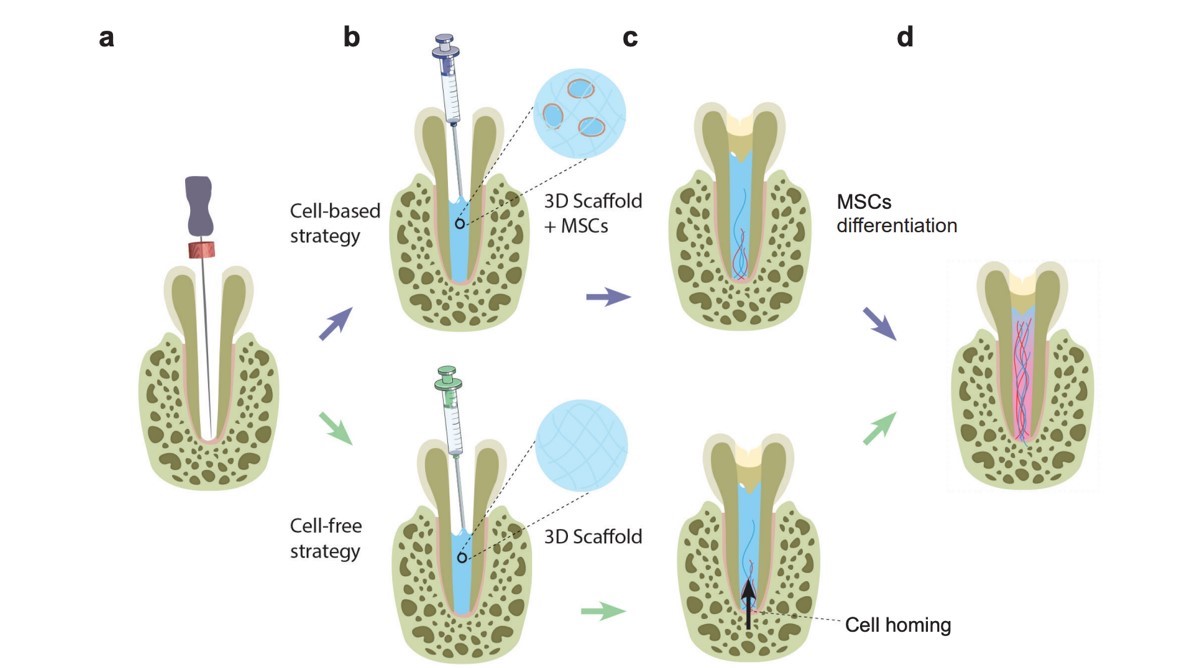
Figure 1 : Illustration des deux stratégies proposées pour la reconstruction de la pulpe dentaire. Une « cell-based strategy » propose d’associer cellules et matériau pour obtenir une différenciation des cellules, alors que la « cell-free strategy » propose de laisser les cellules de l’hôte coloniser l’intérieur de la dent par un phénomène appelé « cell homing ».
Cette thématique de recherche s’inclue dans le projet ENDONANOBIOTIC (soutenu par l’ANR) qui propose la conception d’un hydrogel de régénération, capable (i) de désinfecter totalement l’intérieur de la dent (l’endodonte), (ii) de supporter la croissance et la prolifération de cellules souches de la pulpe dentaire dans le but de reformer une pulpe fonctionnelle et (iii) de réduire l’inflammation pour favoriser une réaction inflammatoire, mais « pro régénérative » (Figure 2).
Pour le projet ENDONANOBIOTIC, le matériau choisi est la fibrine, pour ses propriétés biologiques et sa facilité d’utilisation. Pour l’aspect antibactérien, les antibiotiques apparaissent comme une piste de choix, mais ils présentent des effets potentiellement cytotoxiques pour les cellules souches. Ils participeraient également à créer des mécanismes d’antibiorésistance s’ils sont trop utilisés. Ainsi, pour réduire l’utilisation ou la concentration des antibiotiques, diverses stratégies antibactériennes ont déjà été proposées par l’équipe comme l’adjonction de chitosane dans la fibrine ou encore l’association de nanoparticules de clindamycine qui réduisent le relargage systémique de l’antibiotique. D’autres stratégies alternatives sont actuellement à l’étude.
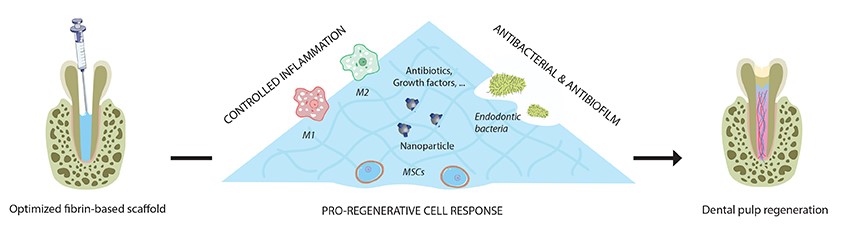
Figure 2 : Illustration des différents axes d’étude du projet ENDONANOBIOTIC.
Sélection de publications :
Richert R, Ducret M, Alliot-Licht B, Bekhouche M, Gobert S, Farges JC. A critical analysis of research methods and experimental models to study pulpitis. Int Endod J. 2022 Mar;55 Suppl 1:14-36. doi: 10.1111/iej.13683. Epub 2022 Feb 2.
Ducret M, Costantini A, Gobert S, Farges JC, Bekhouche M. Fibrin-based scaffolds for dental pulp regeneration: from biology to nanotherapeutics. Eur Cell Mater. 2021 Jan 2;41:1-14. doi: 10.22203/eCM.v041a01.
Renard E, Amiaud J, Delbos L, Charrier C, Montembault A, Ducret M, Farges JC, David L, Alliot-Licht B, Gaudin A. Dental pulp inflammatory/immune response to a chitosan-enriched fibrin hydrogel in the pulpotomised rat incisor. Eur Cell Mater. 2020 Aug 20;40:74-87. doi: 10.22203/eCM.v040a05.
Development of an antibacterial nanocomposite hydrogel for human dental pulp engineering. J Mater Chem B. 2020 Sep 23;8(36):8422-8432. doi: 10.1039/d0tb00989j. PMID: 32804177
– Ducret M, Farges JC, Pasdeloup M, Perrier-Groult E, Mueller A, Mallein-Gerin F, Fabre H. Phenotypic Identification of Dental Pulp Mesenchymal Stem/Stromal Cells Subpopulations with Multiparametric Flow Cytometry. Methods Mol Biol. 2019;1922:77-90. doi: 10.1007/978-1-4939-9012-2_8.
– Ducret M, Montembault A, Josse J, Pasdeloup M, Celle A, Benchrih R, Mallein-Gerin F, Alliot-Licht B, David L, Farges JC. Design and characterization of a chitosan-enriched fibrin hydrogel for human dental pulp regeneration. Dent Mater. 2019 Apr;35(4):523-533. doi: 10.1016/j.dental.2019.01.018. Epub 2019 Jan 31.
– Ducret M, Fabre H, Celle A, Mallein-Gerin F, Perrier-Groult E, Alliot-Licht B, Farges JC. Current challenges in human tooth revitalization. Biomed Mater Eng. 2017;28(s1):S159-S168. PMID: 28372291. doi: 10.3233/BME-171637.
– Ducret M, Fabre H, Degoul O, Atzeni G, McGuckin C, Forraz N, Mallein-Gerin F, Perrier-Groult E, Alliot-Licht B, Farges JC. Immunophenotyping Reveals the Diversity of Human Dental Pulp Mesenchymal Stromal Cells In vivo and Their Evolution upon In vitro Amplification. Front Physiol. 2016 Nov 8;7:512. eCollection 2016. PMID: 27877132. doi: 10.3389/fphys.2016.00512
– Park S-H, Ye L, Love RM, Farges J-C, Yumoto H. Inflammation of the Dental Pulp. Mediat Inflamm 2015; Article ID 980196. doi: org/10.1155/2015/980196.
– Ducret M, Fabre H, Degoul O, Atzeni G, Mcguckin C, Forraz N, Alliot-Licht B, Mallein-Gerin F, Perrier-Groult E, Farges J-C. Manufacturing of dental pulp cell-based products from human third molars : current strategies and future investigations. Front Physiol 2015 ;6:213. doi:10.3389/fphys.2015.00213.
– Ducret M, Fabre H, Farges J-C, Degoul O, Atzeni G, Mcguckin C, Forraz N, Mallein-Gerin F, Perrier-Groult E. Production of human dental pulp cells with a medicinal manufacturing approach. J Endod 2015 ; 41(9):1492-9. doi : 10.1016/j.joen.2015.05.017.
– Farges J-C, Bellanger A, Ducret M, Aubert-Foucher E, Richard B, Alliot-Licht B, Bleicher F, Carrouel F. Human odontoblast-like cells produce nitric oxide with antibacterial activity upon TLR2 activation. Front Physiol 2015 ;6:185. doi : 10.3389/fphys.2015.00185.
– Gaudin A, Renard E, Hill M, Bouchet-Delbos L, Bienvenu-Louvet G, Farges J-C, Cuturi M-C, Alliot-Licht B. Phenotypic analysis of immunocompetent cells in healthy human dental pulp. J Endod 2015 ;41(5):621-7. doi : 10.1016/j.joen.2015.01.005.
– Bonnamain V, Thinard R, Sergent-Tanguy S, Huet P, Bienvenu G, Naveilhan P, Farges J-C, Alliot-Licht B. Human dental pulp stem cells cultured in serum-free supplemented medium. Front Physiol 2013 ;4:357. doi:10.3389/fphys.2013.00357.
Collaborations :
-Pr Colin McGUCKIN & Dr Nico FORRAZ, CTI-BIOTECH, Meyzieu.
-Dr Audrey AUSSEL, Dr Nicolas L’heureux, Dr Olivia Kérourédan, Laboratoire Biotiss, Bordeaux.



