Porteur de projet : F. Mallein-Gerin
Personnes impliquées dans le projet :
Maxime Ducret, Marielle Pasdeloup
L’intérêt de la thérapie cellulaire et de l’ingénierie tissulaire pour réparer le cartilage est grandissant et les chondrocytes articulaires autologues représentent la source la plus communément transplantée. Cependant, les cellules souches mésenchymateuses (CSMs) peuvent être une source cellulaire alternative à condition de développer des protocoles efficaces conduisant à leur conversion chondrogénique et une production de matrice cartilagineuse satisfaisante. Les CSMs peuvent être isolées de nombreux tissus et sont déjà utilisées pour des inductions de différenciations diverses mais avec une efficacité variable, suivant leur origine et le lignage cellulaire recherché. La hiérarchie des CSMs, en fonction de leur tissu d’origine et à l’égard de leur potentiel chondrogénique, reste difficile à établir car les techniques de culture varient d’un laboratoire à l’autre. Nous avons entrepris une analyse comparative par cytométrie de flux de CSMs isolées de la gelée de Wharton (WJ), du tissu adipeux (AT), de pulpe dentaire (DP) et de moelle osseuse (BM). Les cellules ont été cultivées avec le même milieu sans sérum, condition autorisant une application clinique. Nous avons établi une « carte d’identité » de 31 antigènes de surface (Figure 1). Des différences significatives ont été enregistrées entre les catégories de CSMs. Ces sources de CSMs sont ensuite comparées pour leur capacité à s’engager dans le lignage chondrogénique, en absence de sérum. Nous avons développé une méthode originale pour quantifier cette différenciation quand les MSCs sont en 3D, en utilisant la cytométrie de flux et un anticorps dirigé contre l’isoforme IIB du collagène II, isoforme spécifique des chondrocytes.
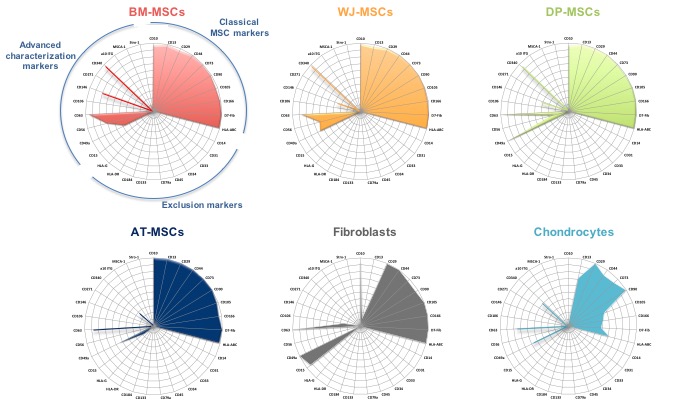
Figure 1: Analyse par cytométrie en flux polychromatique de 31 marqueurs de surface de CSMs (Bone marrow, Wharton’s Jelly, Dental Pulp, Adipose Tissue), fibroblastes et chondrocytes, cultivés sans sérum. Le pourcentage d’expression est représenté sous forme d’image radar. Le nombre de donneurs varie de 3 à 8, selon la catégorie cellulaire.
Sélection de publications :
Fabre H, Ducret M, Degoul O, Rodriguez J, Perrier-Groult E, Aubert-Foucher E, Pasdeloup M, Auxenfans C, McGuckin C, Forraz N, and Mallein-Gerin F. Characterization of Different Sources of Human MSCs Expanded in Serum-Free Conditions with Quantification of Chondrogenic Induction in 3D. Stem Cells International. 2019 Jun 20;2019:2186728. doi: 10.1155/2019/2186728. eCollection 2019.
Ducret M, Farges JC, Pasdeloup M, Perrier-Groult E, Mueller A, Mallein-Gerin F, Fabre H. Phenotypic Identification of Dental Pulp Mesenchymal Stem/Stromal Cells Subpopulations with Multiparametric Flow Cytometry. Methods Mol Biol. 2019;1922:77-90. doi: 10.1007/978-1-4939-9012-2_8.
Rodriguez J, Pratta AS, Abbassi N, Fabre H, Rodriguez F, Debard C, Adobati J, Boucher F, Mallein-Gerin F, Auxenfans C, Damour O, Mojallal A. Evaluation of Three Devices for the Isolation of the Stromal Vascular Fraction from Adipose Tissue and for ASC Culture: A Comparative Study. Stem Cells Int. 2017;2017:9289213. doi: 10.1155/2017/9289213.
Ducret M., Fabre H., Farges J.-C., Degoul O., Atzeni G., McGuckin C., Forraz N., Malleing-Gerin F., Perrier-Groult E. Production of human dental pulp cells with a medicinal manufacturing approach. J. Endod. 2015 ; 41(9):1492-9 doi : 10.1016/j.joen.2015.05.017
Demoor M, Ollitrault D, Gomez-Leduc T, Bouyoucef M, Hervieu M, Fabre H, Lafont J, Denoix JM, Audigié F, Mallein-Gerin F, Legendre F, Galera P. (2014). Cartilage tissue engineering : molecular control of chondrocyte differentiation for proper cartilage matrix reconstruction Biochim Biophys Acta. (general subjects) S0304-4165(14)00091-9
Collaborations :
Céline Auxenfans, Odile Damour, Laboratoire des Substituts Cutanés et Banque de Tissus et de Cellules, Hôpital Edouard Herriot, Lyon
Nicolas Forraz et Colin McGuckin, CTI-BIOTECH, Lyon



