Porteur de projet: Mourad Bekhouche
Personnes impliquées : M DUCRET (PU-PH), J-C FARGES (PU-PH), S THIERRY (IE), M PASDELOUP (IE), M LEVEQUE (étudiante en thèse)
La pulpe dentaire humaine est un tissu conjonctif situé au centre de la dent et qui est responsable de la surveillance immunitaire, de la sensibilité et de la réparation de la dent. L’inflammation de la pulpe dentaire, ou pulpite, est l’infection la plus répandue dans le monde et est caractérisée par la pénétration progressive des bactéries orales dans la dent (Richert R et al., 2022). Le diagnostic actuel de l’inflammation de la pulpe dentaire est basé sur la vitalité de la dent sans tenir compte de l’état inflammatoire et de la capacité de réparation de la dent. Lorsque la pulpite évolue vers une nécrose pulpaire (pulpite irréversible), le traitement consiste à retirer la pulpe dentaire (PD), et à la remplacer par un matériau inerte ce qui conduit à des dents dévitalisées sujettes aux réinfections et aux fractures. Sans traitement adapté, ni outil de diagnostic précis, l’infection peut se propager au niveau systémique et à travers l’extrémité de la dent (apex) affectant ainsi le tissu osseux alvéolaire. Des stratégies thérapeutiques prometteuses, basées sur l’implantation de matrices temporaires à base de fibrine, associée ou non à des cellules souches mésenchymateuses de la pulpe dentaire (CSM-PD), sont proposées pour le rétablissement de la vitalité de la dent chez l’homme (Ducret M et al., 2021 ; Bekhouche M et al., 2020). Cependant, les stratégies de régénération de la pulpe dentaire développées jusqu’à présent conduisent à la formation de tissus dysfonctionnels résultant du dépôt d’une matrice inappropriée par les CSM-PD (cicatriciels ou minéralisés). Les mécanismes biomoléculaires responsables du remplacement de l’hydrogel par une matrice extracellulaire (MEC) de type pulpaire sont totalement inconnus, ce qui constitue un verrou scientifique majeur pour ce type d’approche.
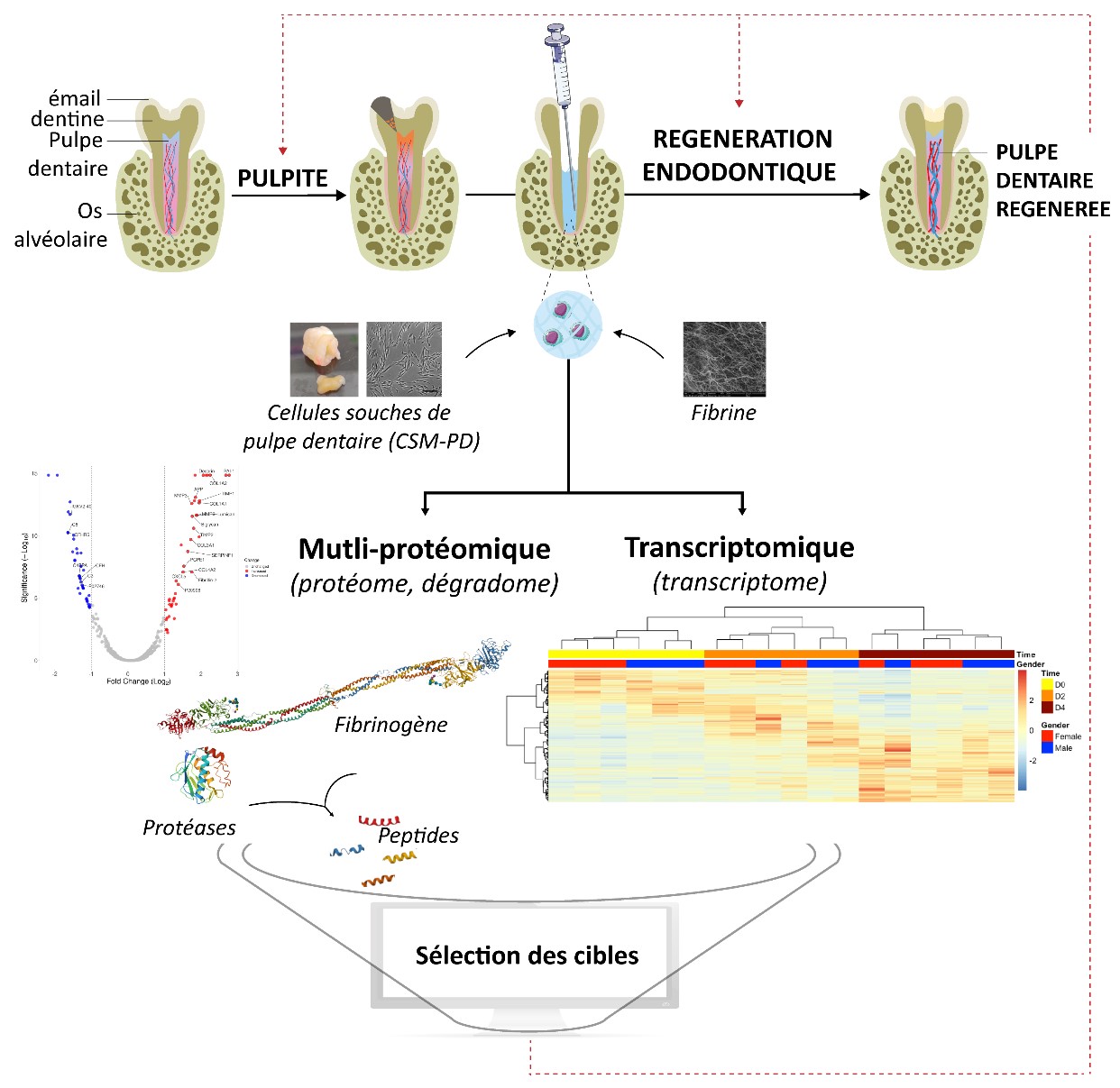
Figure 1 : Investigation multi-omique des mécanismes de réparation/ régénération de la pulpe dentaire.
Nous explorons les mécanismes enzymatiques mis en jeu dans la dégradation de matrices biomimétiques temporaires à base de fibrine et la synthèse de MCE dérivée de cellules souches dans ces environnements. Des approches de protéomique spécifiquement adaptées au décryptage des mécanismes de dégradation/formation de matrice extracellulaire (dégradomique) sont mises en œuvre afin de suivre la dégradation et le remplacement de la matrice de fibrine (Leduc C et al., 2022). Ces études protéomiques sont complétées par des analyses du transcriptome à travers une approche dite multi-omique (ANR TRIDENTOMIC). Ces recherches visent à identifier les biomolécules à cibler afin de guider la formation synchronisée d’un tissu entièrement fonctionnel. Ces cibles biomoléculaires impliquées dans la régénération de la pulpe dentaire constituent également des marqueurs potentiels du pouvoir réparateur de la pulpe dentaire humaine pour l’aide au diagnostic du degré d’inflammation pulpaire (Figure 1). L’ensemble de ces méthodes d’investigations, visant à évaluer la dégradation de matrices biomimétiques temporaires à base de fibrine et la synthèse matricielle dérivée de cellules, sont également mises en œuvre pour l’investigation de la réparation d’autres tissus squelettiques (os, cartilage).
Sélection de publications:
- Richert R, Ducret M, Alliot-Licht B, Bekhouche M, Gobert S & Farges J-C. A critical analysis of research methods and experimental models to study pulpitis. International Endodontic Journal (IEJ) 2022. doi: 10.1111/iej.13683
- Leduc C, Dupont L, Joannes L, Monseur C, Baiwir D, Mazzucchelli G, Deroanne C, Colige A and Bekhouche M. In vivo N-terminomics highlights novel functions of ADAMTS2 and ADAMTS14 in skin collagen matrix building. Frontiers in Molecular Biosciences 2021: 8:643178.
- Ducret M, Costantini A, Gobert S, Farges JC, Bekhouche M. Fibrin-based scaffolds for dental pulp regeneration: from biology to nanotherapeutics. European Cells and Materials 2021: 41, p. 1-14.
- Bekhouche M, Bolon M, Charriaud F, Lamrayah M, Da Costa D, Primard C, Costantini A, Pasdeloup M, Gobert S, Mallein-Gerin F, Verrier B, Ducret M, Farges JC. Development of an antibacterial nanocomposite hydrogel for human dental pulp engineering. Journal of Materials Chemistry B 2020: 8(36), p. 8422-8432.
Collaborations :
– Pr. Meriam BRICHA – Université Euromed de Fès (Maroc)
– Pr. Tchilalo BOUKPESSI – Université Paris Descartes



