Porteurs de projet : Jérôme Sohier (CR CNRS)
Personnes impliquées dans le projet : Kardelen Durmaz (doctorante), Lucas Lemarié (Doctorant), Danielle Campiol Arruda (MCU), Jean-Paul Salvi (T)
Financements: ANR MICROVOICE, ANR GELIHPARBAL, FUI SPINEFLEX, PREMATURATION CNRS, CIFRE
Collaborations: Vincent Gache (INMG, Lyon), E. Courtial (ICBMS, Lyon), L. Bailly (3SR, Grenoble), C. Vezy (UTT, Troyes), Pr. L. Moroni (Université de Maastricht, Pays-Bas), Pr. M. Yacoub (Imperial college, London, Angleterre), NORAKER (Lyon), SEGULA.
Notre problématique de recherche concerne le développement de biomatériaux pour mettre en évidence et orienter le comportement cellulaire, afin d’offrir des solutions thérapeutiques innovantes et fonctionnelles.
Hydrogels bioactifs et modulation du comportement cellulaire
La structure est l’organisation spécifique de la MEC est une composante essentielle des propriétés des tissus natifs, régénérés ou cicatrisés, particulièrement en ce qui concerne les tissus mous. Mimer la composante fibrillaire de la MEC ainsi que sa partie hydratée apparait fondamental pour fournir des outils de compréhension des réactions cellulaires.
Dans cette optique, nous avons développé des hydrogels innovants et versatiles à partir de molécules standardisées de poly(ethylène glycol) et de dendrimères de lysine (DGL). Ces biomatériaux sont biocompatibles, hautement modulables en termes de composition chimique, de charge de surface et de propriétés mécaniques et permettent une interaction intrinsèque avec les cellules.
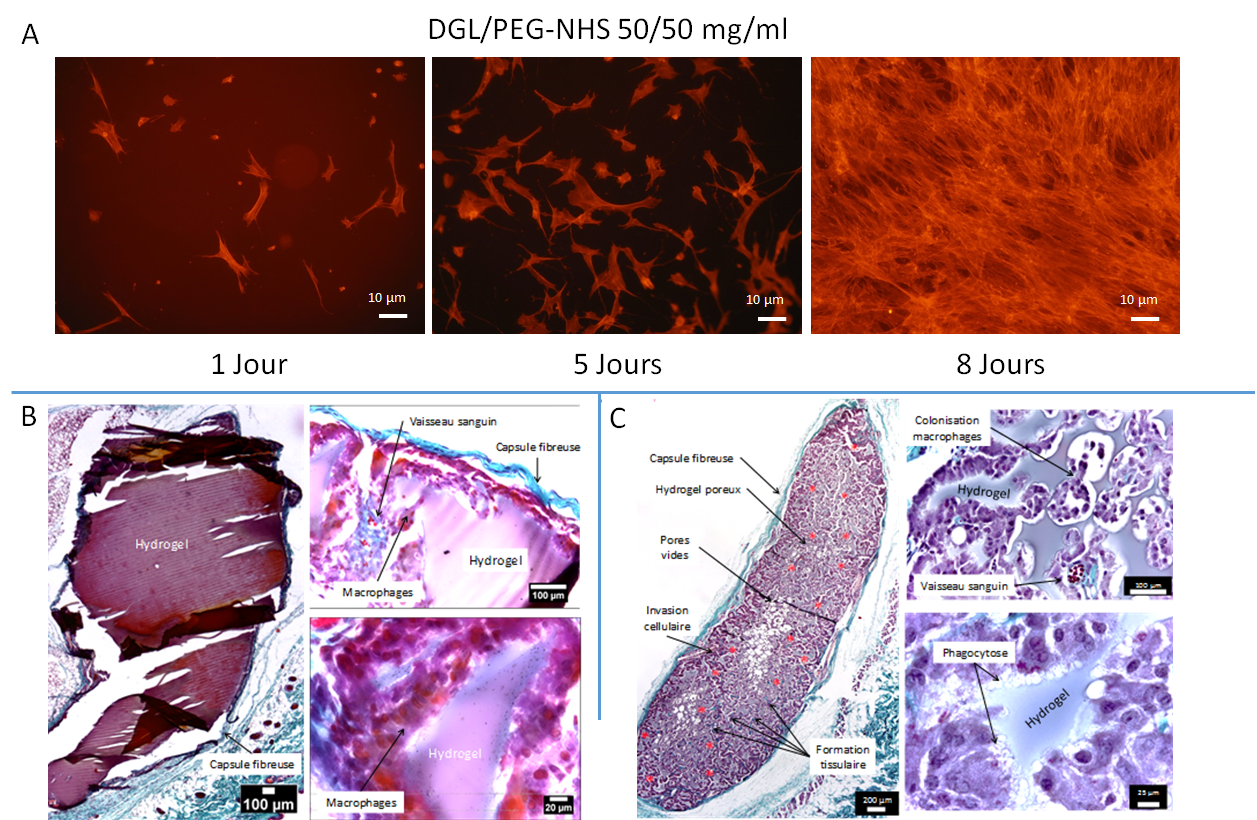
Morphologie et prolifération de fibroblastes humains à la surface d’hydrogels (A). Implantation sous-cutanée de différents hydrogels chez la souris : hydrogels denses DGL/PEG-NHS 50/50 mg/ml (D) ; hydrogels DGL/PEG-NHS 50/50 mg/ml contenant 3.75 mg/ml de PDE et de porosité 100-50 µm (E). Coloration au trichrome de Masson qui indique le collagène en bleu turquoise. Les vaisseaux sanguins infiltrés sont indiqués par un astérisque rouge.
Les propriétés versatiles de ces hydrogels nous permettent d’étudier les relations entre le comportement de différents types cellulaires et les propriétés mécaniques et de surface du microenvironnement synthétique.
Par ailleurs la formulation aqueuse directe de ces hydrogels permet d’y incorporer des agent bioactifs (molécules, protéines ou nanoparticules) et de les libérer de façon contrôlée.
Ils permettent ainsi de définir des supports d’ingénierie tissulaire et de formation de modèles tissulaires cellularisés (dans le cas du muscle ou de la peau) ou acellulaires (corde vocale ou vaisseaux sanguins).
Reconstruction du tissu musculaire squelettique dans de grands défauts
Les plaies musculaires profondes entrainent une cicatrisation fibreuse pathologique, qui ne permet plus d’assurer une contractilité fonctionnelle et résulte souvent en une invalidité élevée.
Notre projet a consisté à déterminer les propriétés optimales d’adhésion, de migration et de prolifération à la surface de l’hydrogel, pour des myoblastes murins ou humains, afin d’élaborer des formulations poreuses soutenant la fusion des myoblastes en myotubes et en fibres musculaires fonctionnelles et contractiles, dont les sarcomères sont caractérisés par la présence de striation de l’α-actinine. Le microenvironnement tridimensionnel fourni par ces conditions contribue également à induire spontanément un pool de cellules souches musculaires quiescentes, caractérisées par une expression de PAX7 et l’absence d’expression des marqueurs Ki67 et MyoD.
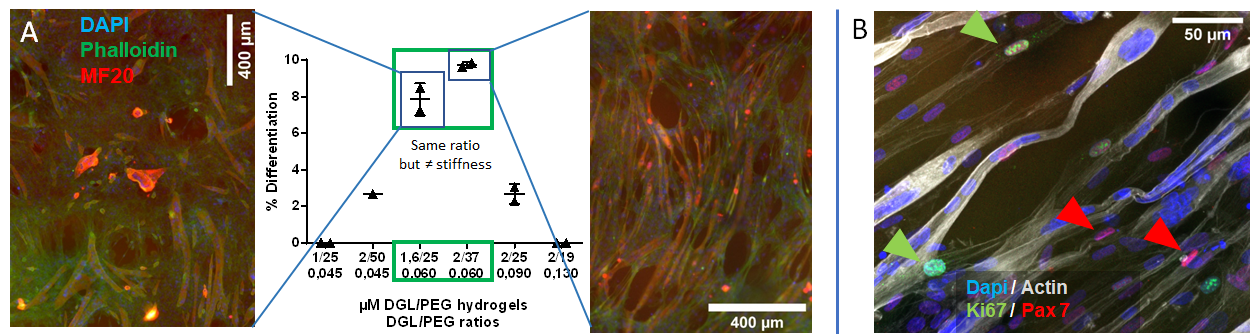
Influence de la composition de l’hydrogel DGL/PEG sur la capacité de fusion et de différenciation des C2C12 murines après 6 jours de culture, visualisé par le marquage des chaînes lourdes de myosine (MF20) et par le nombre de noyaux par cellule (A) ; et population de cellules mononuclées non prolifératives (absence d’expression de Ki67) et exprimant Pax7, parmi les myotubes formés après 6 jours de culture dans les hydrogels poreux (B).
Pour évaluer l’utilité de notre hydrogel dans le contexte de la réparation musculaire, nous avons élaboré, pour la première fois, une formulation effervescente et directement injectable in-situ. Cette formulation permet d’injecter aisément l’hydrogel directement dans un défaut musculaire, tandis qu’une porosité hautement interconnectée se forme par effervescence concomitamment à l’injection. La structure de la porosité et son interconnexion permettent une colonisation importante et rapide par des myoblastes et des cellules souches musculaires, ainsi que leur fusion et différenciation en myotubes. Indiquant un potentiel certain en tant que support de formation tissulaire, ces hydrogels poreux permettent une vascularisation, une invasion cellulaire et une déposition de MEC importante quand ils sont injectés in vivo en sous-cutané.
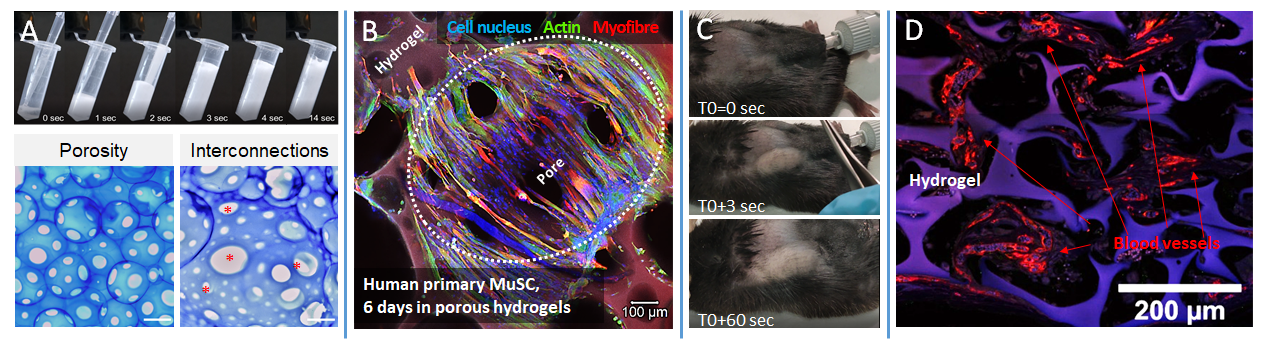
Formulation effervescente de l’hydrogel (A) et porosité interconnectée résultante (A ; échelle 400 µm). Colonisation des matrices poreuses résultantes par des myoblastes humains et différenciation en myofibres après 6 jours de culture (B). Injection des formulations en sous-cutané dans un modèle murin (C) et exemple représentatif de néovascularisation observée après 3 semaines d’implantation (D). D’après Griveau, Lafont et al. 2021.
L’évaluation in vivo dans des grand défauts musculaires chez le rat, actuellement en cours, permettrons de valider notre approche tant sur le plan histologique que fonctionel.
Modélisation des plis vocaux
Le pli vocal est un tissu aux propriétés extraordinaires, mais dont peu de choses sont connues, notamment en ce qui concerne le lien entre la microstructure du pli vocal, son comportement biomécanique et ses propriétés vibratoires remarquables.
En explorant l’architecture fibreuse 3D du pli vocal humain et en concevant des matériaux composites fibreux/hydrogels mimétiques, aux propriétés structurales et biomécaniques ajustables; nous pourrons fournir des éléments de réponses quant aux liens entre les performances vibromécaniques des tissus vocaux et leurs microstructures fibreuses et leurs matrices environnantes.
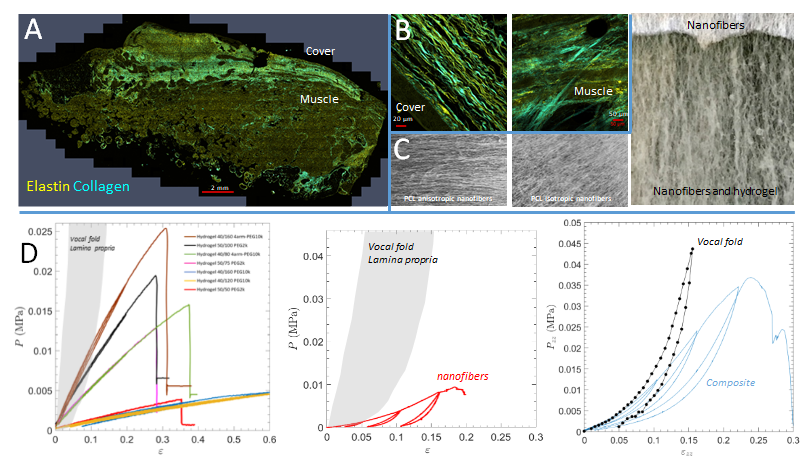
Vues par microscopie confocale biphotonique d’un pli vocal humain montrant la localisation (A) et l’organisation du
réseau de collagène et d’élastine (B). Nanofibres de polycaprolactone mimant ces architectures et permettant de former
des composites incluant l’hydrogel (C). Propriétés mécaniques en tractions des matrices d’hydrogels, de nanofibres et
des composites, en comparaison de celles de plis vocaux humains (D).
Sélection de publications :
A. Danoy, K. Durmaz, M. Paoletti, L. Vachez, A. Roul, J. Sohier, B. Verrier. Aqueous suspensions of Fuller’s earth potentiate the adsorption capacities of Paraoxon and improve skin decontamination properties. Journal of Hazardous Materials. 2022. 425: p. 127714. 10.1016/j.jhazmat.2021.127714
Ramirez Caballero S., Ferri Angulo, D., Debret, R., Granier, F., Marie, S., Lefèvre, F-X., Bouler, J-M, Despas, C., Sohier, J., Bujoli, B. Combination of biocompatible hydrogel precursors to apatitic calcium phosphate cements (CPCs): Influence of the in-situ hydrogel reticulation on the CPC properties. Journal of Biomedical Materials Research B: Applied Biomaterials. 2021 Jan;109(1):102-116. 10.1002/jbm.b.34685
Griveau, L., Lafont, M., le Goff, H., Drouglazet, C., Robbiani, B., Berthier, A., Sigaudo-Roussel, D., Latif, N., Le Visage, C., Gache, V., Debret, R., Weiss, P., Sohier, J. (2021). Design and characterization of an in vivo injectable hydrogel with effervescently generated porosity for regenerative medicine applications. Acta Biomaterialia: 2021 2022. 140: p. 324-337. 10.1016/j.actbio.2021.11.036
Carrancá, M., Griveau, L., Remoué, N., Lorion, C., Weiss, P., Orea, V., Sigaudo-Roussel, D., Faye, C., Ferri Angulo, D., Debret, R., Sohier, J. (2021) Versatile lysine dendrigrafts and polyethylene glycol hydrogels with inherent biological properties: in vitro cell behavior modulation and in vivo biocompatibility. Journal of Biomedical Materials Research A. 109(6):926-937; 10.1002/jbm.a.37083.



