Porteur de projet : Romain Debret (CR)
Membres du groupe de recherche : Aurore Berthier (AI), Sarah Chanteloube (Doc.), Chloé Chave (Doc.), Thibault Massias (Postdoc.), Guillaume Fossas (Int. pharm.), Valentin Lequeux (int. pharm.), Jorgan Guard (M2), Fabrice Pirot (PU-PH, équipe 5).
Collaborateurs LBTI : Ming Lo (MCF, équipe 1), Kiaoling Liu Lo (MCF, équipe 1), Elise Lambert (MCF, équipe 3), Jérôme Sohier (CR, équipe 5), Danielle Campiol-Arruda (MCF, équipe 5), Jean-Paul Salvi (TCN, équipe 5)
Collaborateurs académiques : Serge Adnot (IMRB, Créteil), Stéphane Avril (Sainbiose, Saint-Etienne), Gilles Faury (HP2, Grenoble), Daniella Quaglino (Université de Modène, Italie), Dieter Reinhardt (Université McGill, Canada), Cyril Pailler-Mattéi (LTDS, Ecully), Yibing Qyang (Université de Yale, USA)
Collaborations industrielles : Lucas Meyer Cosmetics, Isispharma, BASF-Beauty Care Solutions
Financements publics : ANR « Arterylastic » (www.arterylastic.com), ANR « TherAlveo », Programme DECLIC (INSB, CNRS)
Les fonctions physiologiques de nombreux tissus sont dépendantes de leurs propriétés élastiques. Les fibres élastiques sont des composants essentiels de la matrice extracellulaire (MEC), responsables de la résilience des tissus des vertébrés. Ces structures sont trouvées en abondance dans les tissus tels que la peau, les artères, les poumons et les ligaments, soumis à de fortes contraintes mécaniques nécessitant des cycles répétés d’extension et de retour à leur structure d’origine. Ces fibres sont constituées à 90% d’élastine, un polymère formé par la réticulation de la tropoélastine, et à 10 % de microfibrilles riches en fibrillines. La maturation de l’ensemble est assurée par l’action enzymatiques de la famille des lysyls oxydases.
Les fibres élastiques sont synthétisées (élastogenèse) lors du dernier tiers de la période fœtale, et un pic de synthèse péri-natal est observé avant de décroître progressivement pendant la croissance. A l’âge adulte (environ 20 ans chez l’Homme), l’élastogenèse est très faible et le renouvellement n’est que partiel. Ainsi, le capital élastique constitué au jeune âge diminue progressivement au cours du temps avec des conséquences importantes sur les fonctions physiologiques. Le vieillissement est donc lié à l’intégrité des fibres élastiques. De ce fait, les pathologies syndromiques génétiques (cutis laxa, Williams-Beuren) qui affectent les fibres élastiques, ou toute situation pathologique engendrant la destruction des fibres de manière exacerbée (inflammation, malnutrition, stress…), participent à l’établissement d’un phénotype progéroïde localisé ou systémique.
Le groupe de recherche ACTE a pour but de comprendre l’impact des modifications d’élasticité sur le comportement cellulaire, et vise à développer des thérapies innovantes pour rétablir l’élasticité des tissus avec la peau comme modèle d’étude. Nos projets sont donc organisés selon 2 axes distincts.
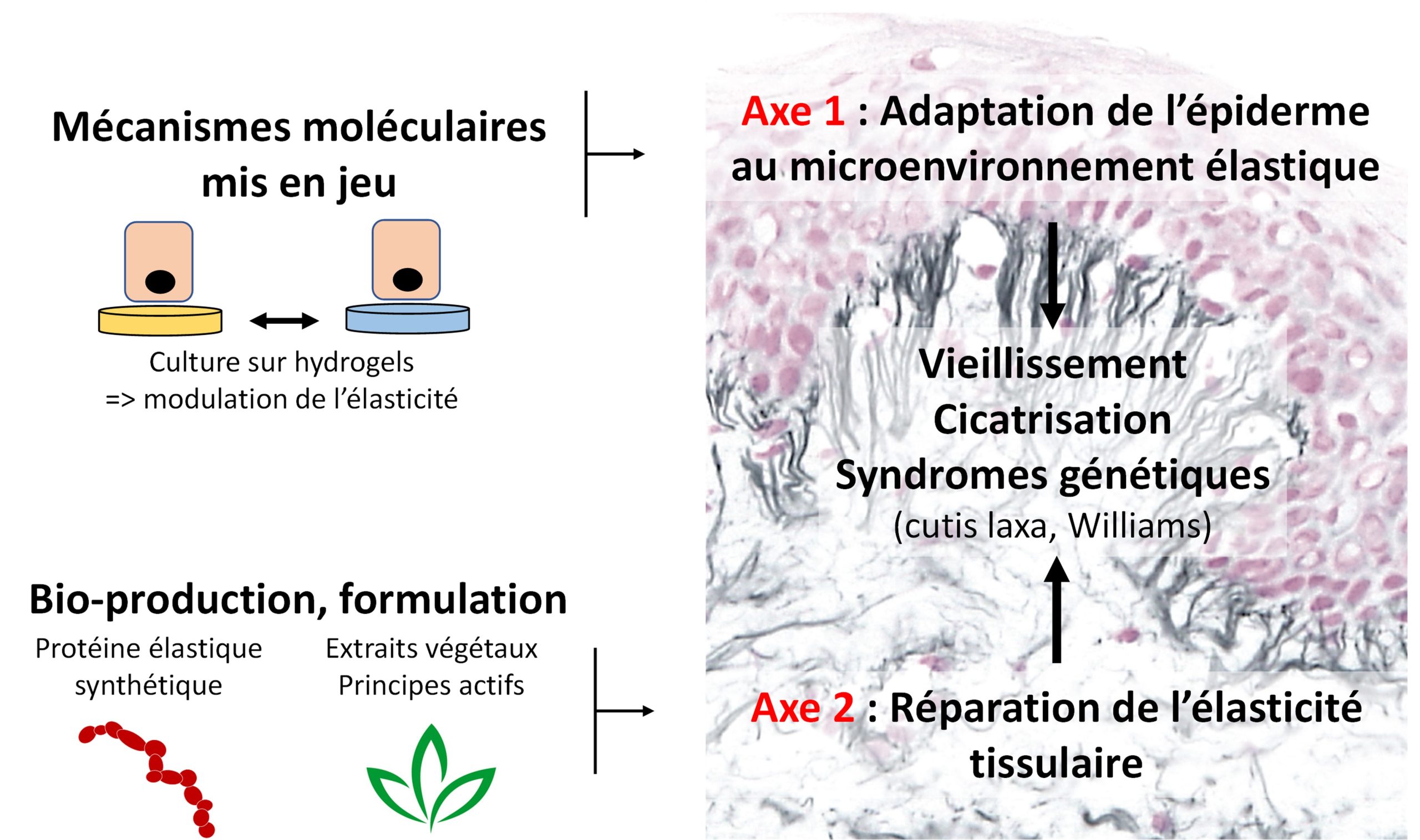
Stratégie globale du groupe de recherche ACTE
AXE I : Adaptation de l’épiderme au microenvironnement élastique
Cet axe à forte connotation mécanobiologique cherche à déterminer les mécanismes moléculaires permettant aux kératinocytes (cellules de l’épiderme) de répondre aux changements de rigidité/élasticité dans les contextes de vieillissement et de cicatrisation cutanés pour lesquels les kératinocytes sont exposés à de fortes variations de leur environnement mécanique.
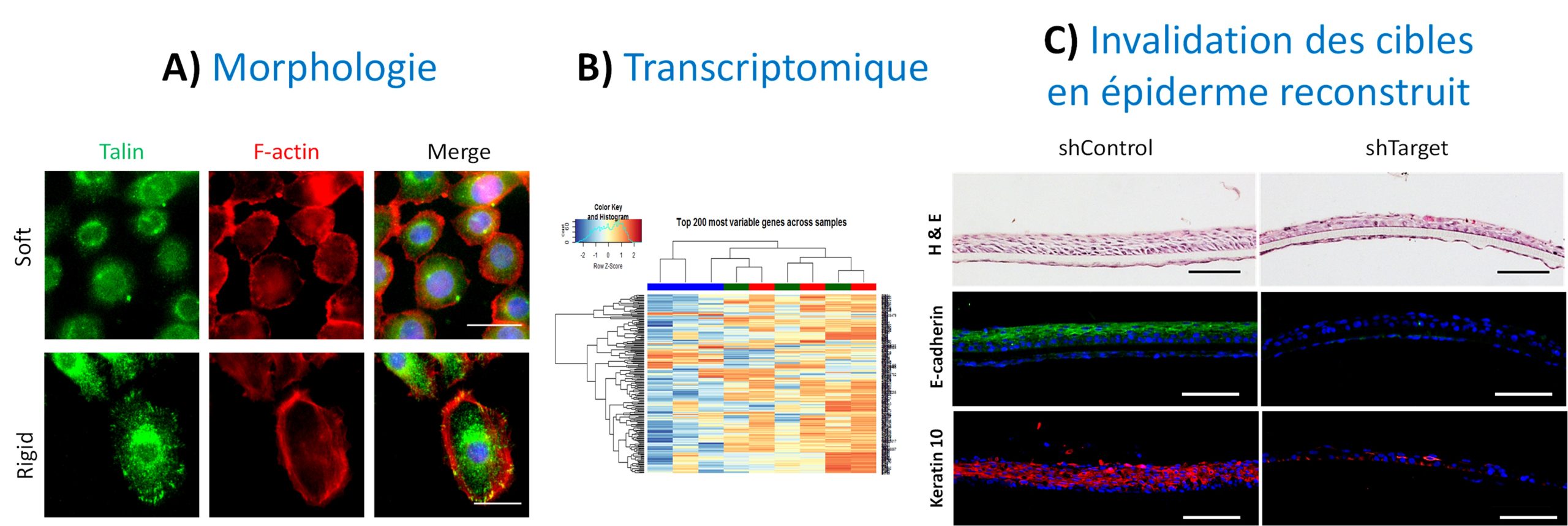
Identification de nouvelles voies mécano-réceptives dans le kératinocyte
A) Analyses de la morphologie des kératinocytes en réponse à la rigidité par microcopie à fluorescence. Barre d’échelle = 25 µm. B) Analyse du transcriptome kératinocytaire par séquençage ARN et identification de cibles mécano-répondantes. C) Reconstruction d’épiderme à partir de kératinocytes invalidés pour une cible identifiée dans le RNAseq. Barre d’échelle = 100 µm.
AXE II : Réparation de l’élasticité tissulaire
Cet axe ambitieux entend pour la première fois fournir des solutions pharmacologiques aux défauts d’élasticité à l’échelle des tissus (peau, vaisseaux, poumons), voire des organismes, l’élasticité étant systémique. Pour cela 2 stratégies complémentaires sont développées : 1) la purification d’extraits végétaux actifs ; 2) l’utilisation d’une protéine élastique synthétique en tant qu’agent bio-thérapeutique.
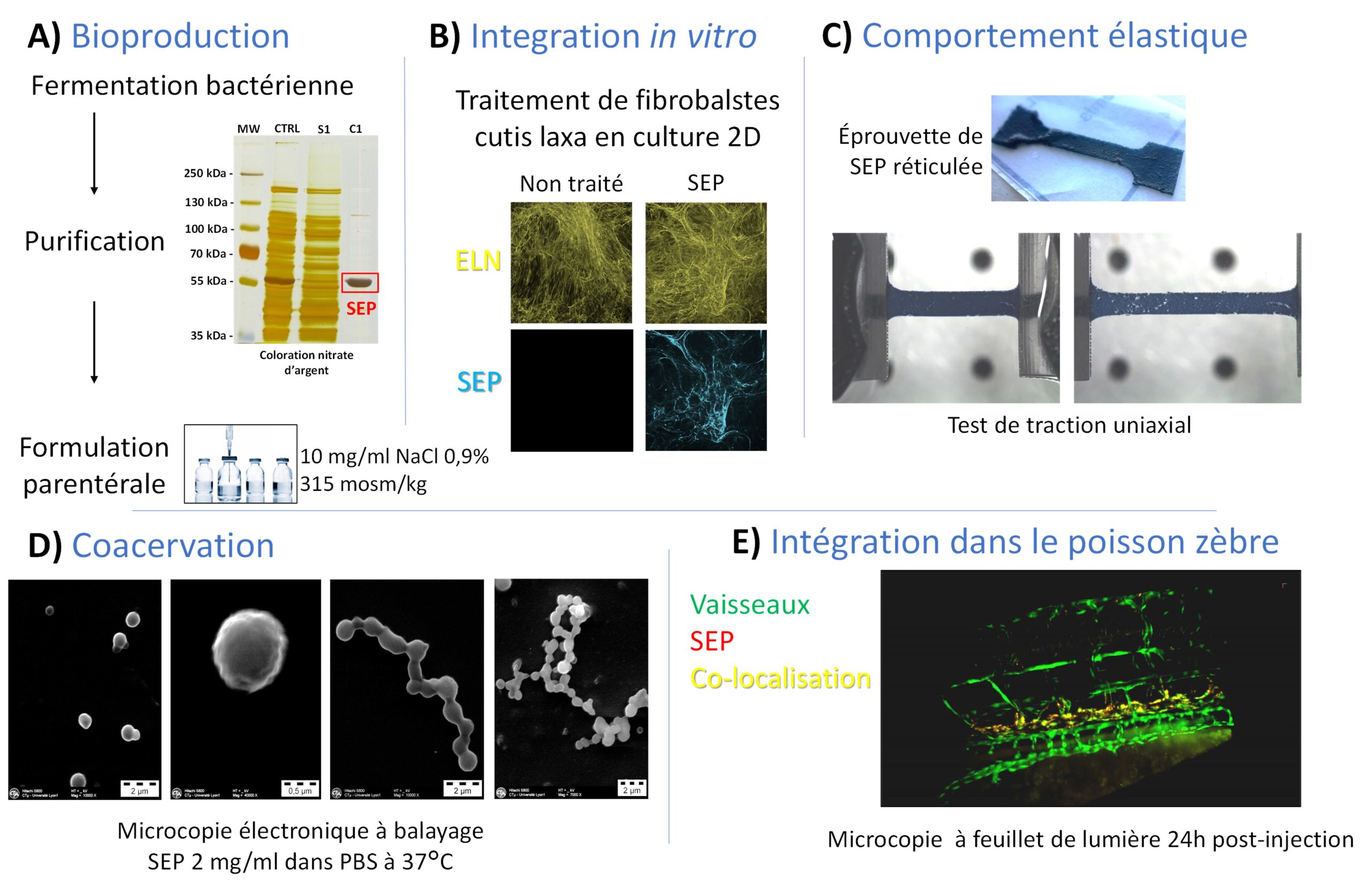
Production et caractéristiques de la protéine élastique synthétique (SEP)
A) Bioproduction en système procaryote couplé à une purification par Inverse Transition Cycling et données de la formulation parentérale. B) Exemple d’intégration de la SEP dans les dépôts fibrillaires de tropoélastine à partir de cellules cutis laxa en culture. C) Illustration du comportement purement élastique de la SEP lors de mesures par test de traction uniaxial. D) Capacité de coacervation à 37°C similaire à la tropoélastine native. E) Microscopie à feuillet de lumière 24h post-injection de la SEP dans un poisson zèbre.
Sélection de publications :
Hoareau M, Lorion C, Lecoq L, Berthier A, Pierrat B, Avril S, Pirot F, Sommer P, Sohier J, Lambert E, Debret R. A synthetic elastic protein as molecular prosthetic candidate to strengthen vascular wall elasticity. bioRxiv 2023.11.30.569188; doi: 10.1101/2023.11.30.569188
Chanteloube S, Ya C, Le Provost G, Berthier A, Dieryckx C, Vadon-Le Goff S, Nadal F, Fromy B, Debret R. GPRC5A regulates keratinocyte adhesion and migration through nuclear translocation of its C-terminus region. bioRxiv 2023.11.28.569012; doi: 10.1101/2023.11.28.569012
Hoareau M, El Kholti N, Debret R, Lambert E. Zebrafish as a Model to Study Vascular Elastic Fibers and Associated Pathologies. Int J Mol Sci. 2022 Feb 14;23(4):2102. doi: 10.3390/ijms23042102.
Boizot J, Minville-Walz M, Reinhardt DP, Bouschbacher M, Sommer P, Sigaudo-Roussel D, Debret R. FBN2 Silencing Recapitulates Hypoxic Conditions and Induces Elastic Fiber Impairment in Human Dermal Fibroblasts. Int J Mol Sci. 2022 Feb 5;23(3):1824. doi: 10.3390/ijms23031824.
Ya C, Carrancá M, Sigaudo-Roussel D, Faure P, Fromy B, Debret R. Substrate softness promotes terminal differentiation of human keratinocytes without altering their ability to proliferate back into a rigid environment. Arch Dermatol Res. 2019 Dec;311(10):741-751. doi: 10.1007/s00403-019-01962-5.
Mainzer C, Remoué N, Molinari J, Rousselle P, Barricchello C, Lago JC, Sommer P, Sigaudo-Roussel D, Debret R. In vitro epidermis model mimicking IGF-1-specific age-related decline. Exp Dermatol. 2018 May;27(5):537-543. doi: 10.1111/exd.13547.
Moulin L, Cenizo V, Antu AN, André V, Pain S, Sommer P, Debret R. Methylation of LOXL1 Promoter by DNMT3A in Aged Human Skin Fibroblasts. Rejuvenation Res. 2017 Apr;20(2):103-110. doi: 10.1089/rej.2016.1832.
Boraldi F, Bartolomeo A, Annovi G, Debret R, Quaglino D. Magnesium Modifies the Structural Features of Enzymatically Mineralized Collagen Gels Affecting the Retraction Capabilities of Human Dermal Fibroblasts Embedded within This 3D System. Materials (Basel). 2016 Jun 15;9(6):477. doi: 10.3390/ma9060477.
Debret R, Cenizo V, Aimond G, André V, Devillers M, Rouvet I, Mégarbané A, Damour O, Sommer P. Epigenetic silencing of lysyl oxidase-like-1 through DNA hypermethylation in an autosomal recessive cutis laxa case. J Invest Dermatol. 2010 Nov;130(11):2594-601. doi: 10.1038/jid.2010.186.



