Porteur de projet : S. Richard (MCU)
Personnes impliquées dans le projet : E. Colomb (IE), A, N. El Kholty (AI), E. Lambert (MCU), D. Le Guellec (PU), C. Phelip (doctorante), M. Lamrayah (PhD student).
Pour améliorer la délivrance de médicaments ou d’antigènes vaccinaux, nous élaborons des nanoparticules de PLA multifonctionnelles capables de cibler des sous-populations cellulaires spécifiques impliquées dans l’immunité muqueuse. Comprendre comment les nanovecteurs franchissent les barrières biologiques et atteignent leurs cibles in vivo est essentiel pour leur développement technologique. Nous étudions ainsi la biodistribution des nanoparticules, au niveau des cellules et des tissus. Nous utilisons divers modèles: la souris, le poisson zèbre et des cultures de cellules épithéliales et immunitaires, grâce auxquels nous étudions la prise en charge cellulaire et subcellulaire des nanoparticules de PLA, par des approches d’imagerie.
> Biodistribution des nanoparticules chez les mammifères
Le transport et le devenir des nanoparticules de PLA dans les tissus biologiques sont suivis dans des modèles in vivo tels que des souris transgéniques et des primates non humains (en collaboration avec IDMIT, CEA). Par des tests ex vivo réalisés sur des anses intestinales ligaturées de souris, nous avons montré que les nanoparticules de PLA traversent la muqueuse intestinale au niveau des plaques de Peyer. Après administration de nanoparticules à l’animal vivant, la biodistribution est analysée par tomographie par fluorescence, ainsi que par des approches d’histologie et de microscopie confocale sur des organes disséqués tels que des biopsies cutanées ou des ganglions lymphatiques.
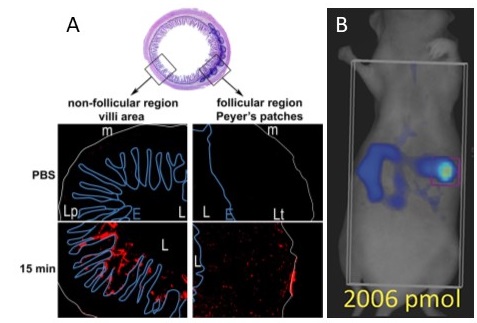
A : Cryosections transversales d’ileum de souris, après ligature in vivo de l’anse intestinale et administration intraluminale de nanoparticules de PLA fluorescentes rouges. Ligne bleue : épithélium, ligne blanche : musculaire, L : lumen. Les nanoparticules sont présentes dans le mucus et ont pénétré la muqueuse intestinale au niveau des plaques de Peyer (Primard et al. 2010). B : Imagerie par tomographie (FMT4000) d’une souris après administration orale de nanoparticules fluorescentes (C.Phelip).
> Prise en charge et biodistribution dans le poisson zèbre
Un avantage majeur du poisson zèbre est la facilité qu’il offre pour l’imagerie corps entier. Les alevins de poisson zèbre sont transparents et la lignée mutante casper reste semi-transparente même au stade adulte, ce qui permet leur observation par microscopie de fluorescence non invasive. La petite taille des poissons zèbre facilite également la micro-section de l’ensemble de l’organisme, ce qui rend les études de biodistribution beaucoup plus simple dans le poisson zèbre que dans tout autre modèle de vertébré. Nous analysons comment les tissus répondent à la présence des nanovecteurs, quelles cellules les prennent en charge et par quels mécanismes.
En combinant les études de microscopie et d’imagerie en flux, nous avons montré que les nanoparticules de PLA traversent les muqueuses au niveau des branchies, des intestins et de la peau (qui constituent une muqueuse dans les organismes aquatiques) et sont accumulées efficacement dans des cellules présentatrices d’antigènes présentes dans ces muqueuses (Rességuier et al., Front. Immun 2017). A l’aide de poissons zèbre transgéniques, nous examinons in vivo l’efficacité de ciblage et de délivrance de différentes formulations. Nous développons des approches techniquement difficiles telles que l’imagerie in toto et la microscopie corrélative. Nous utilisons également le poisson zèbre comme modèle pour les études de toxicité de nos systèmes particulaires.
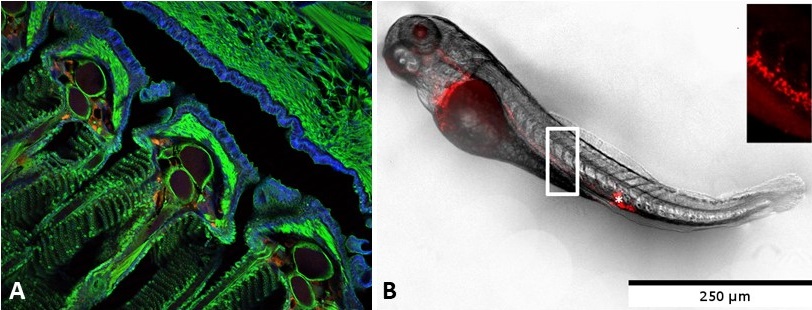
A : Prise en charge de nanoparticules de PLA rouges au niveau des branchies après administration muqueuse chez le poisson adulte (J. Rességuier). B : Biodistribution des nanoparticules de PLA rouges après injection intraveineuse dans un poisson zèbre de 3 jours.
> Utilisation de ligands d’intégrine pour augmenter le transport de nanoparticules de PLA à travers la peau et les muqueuses et la délivrance à des cellules immunitaires sous-épithéliales
Le ciblage est réalisé en recouvrant les nanoparticules de molécules spécifiques selon des stratégies inspirées de modèles cellulaires ou viraux. Par exemple, nous avons fonctionnalisé des nanoparticules avec des ligands d’intégrine afin d’améliorer leur prise en charge par des cellules exprimant α5β1, telles que les cellules microfold (M) du tractus digestif (spécialisées dans la transcytose d’antigène), les cellules dendritiques dermiques et, plus généralement, une large gamme de cellules qui interagissent avec la fibronectine dans des tissus normaux ou pathologiques.
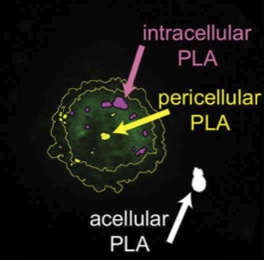
Internalisation de nanoparticules de PLA recouvertes de ligands d’intégrine dans des cellules HT1080 (Dalzon, Lebas, Gimenez et al. 2016).
> Devenir intracellulaire des nanoparticules de PLA
Il est essentiel de mieux comprendre le devenir des nanoparticules et de leur chargement dans les cellules : toutes les nanoparticules restent-elles dans un compartiment cellulaire alors que leur cargaison hydrophobe diffuse dans le cytosol ? Existe-t-il une proportion de nanoparticules intactes qui sont relâchées avec leur cargaison dans le cytosol ? Nous analysons ces questions à l’aide d’une variété d’approches de traçage et d’imagerie en flux, microscopie laser et microscopie électronique.
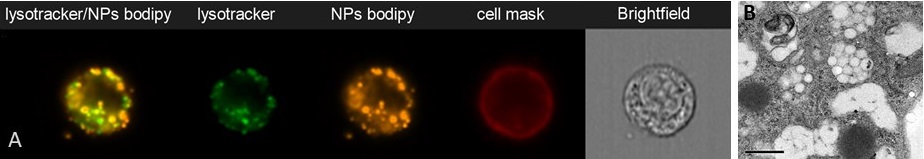
Accumulation de nanoparticules de PLA dans les compartiments endosomaux de cellules dendritiques de souris (SRDC), observée par imagerie en flux (ImagestreamX, A) (P. Mercier) ou en microscopie électronique à transmission (B, Aline et al. 2009)
Sélection de publications
Rességuier J, Delaune E, Coolen A-L, Levraud J-P, Boudinot P, Le Guellec D and Verrier B (2017) Specific and Efficient Uptake of Surfactant-Free Poly(Lactic Acid) Nanovaccine Vehicles by Mucosal Dendritic Cells in Adult Zebrafish after Bath Immersion. Front. Immunol. 8:190. doi: 10.3389/fimmu.2017.00190
Dalzon B, Lebas C, Jimenez G, Gutjahr A, Terrat C, Exposito J-Y, et al. (2016) Poly(Lactic Acid) Nanoparticles Targeting α5β1 Integrin as Vaccine Delivery Vehicle, a Prospective Study. PLoS ONE 11(12): e0167663.
Stability Of Polylactic Acid Particles And Release Of Fluorochromes Upon Topical Application On Human Skin Explants. Liard C, Munier S, Joulin-Giet A, Bonduelle O, Hadam S, Duffy D, Vogt A, Verrier B, Combadière B (2012) Eur J Pharm Biopharm 31 : 6060-8
Rancan F, Todorova A, Hadam S, Papakostas D, Luciani E, Graf C, Gernert U, Ruhl E, Verrier B, Sterry W, Blume-Peytavi U, VogtA (2012). Intradermal immunization triggers epidermal Langerhans cell mobilization required for CD8 T-cell immune responses. J Invest Dermatol 132(3 Pt 1):615-25
Liard C, Munier S, Joulin-Giet A, Bonduelle O, Hadam S, Duffy D, Vogt A, Verrier B, Combadière B(2012). Stability Of Polylactic Acid Particles And Release Of Fluorochromes Upon Topical Application On Human Skin Explants. Eur J Pharm Biopharm 31 : 6060-8
Primard C, Rochereau N, Luciani E, Genin C, Delair T, Paul S, Verrier B (2010). Traffic Of Poly(lactic Acid) Nanoparticulate Vaccine Vehicle From Intestinal Mucus To Sub-epithelial Immune Competent Cells. Biomaterials 31 : 6060-8
Aline F, Brand D, Pierre J, Roingeard P, Munier S, Verrier B, Dimier-Poisson I (2009). Dendritic cells loaded with HIV-1 p24 proteins adsorbed on surfactant-free anionic PLA nanoparticles induce enhanced cellular immune responses against HIV-1 after vaccination. Vaccine 27(38):5284-91.
Collaborations:
UMS 3444 (ImageStreamX, Cytof, PRECI, PLATIM)
Centre d’imagerie des microstructures
Dr. J.P. Levraud (Pasteur Institute, Paris)
Dr. P. Boudinot (INRA, Jouy en Josas),
Dr. J.S. Joly (CNRS, Gif-sur-Yvette)
Dr. P. Affaticati (Tefor Core Facility, Gif-sur-Yvette)
Projets financés : PECSDDeli, BQR, ADITEC, Fish-RNAvax




